
CHAPTER 3
Matter
1.
has mass; occupies space
2.
intermolecular forces
3.
liquids; solids
4.
liquids
5.
In solids, the particles are essentially fixed in position relative to one another and can only vibrate
in place. In liquids, the particles are still in close proximity to one another, but are able to move in
three dimensions relative to one another. In gases, the particles are not in close proximity to each
other and move freely and independently of one another.
6.
gaseous
7.
One similarity is that solids and liquids both have a definite volume. They also have less
molecular motion as compared to gases. Differences include that solids are rigid and have a fixed
shape, whereas liquids have no rigid shape and take on the shape of its container. Molecules in
the liquid phase also have more molecular motion compared to molecules in the solid phase.
8.
The stronger the inter-particle forces, the more rigid is the sample overall.
9.
The gaseous 10-g sample of water has a much larger volume than either the solid or liquid
samples. Although the 10-g sample of water vapor contains the same amount of water as the solid
and liquid sample (the same number of water molecules), there is a great deal of empty space in
the gaseous sample.
10.
Gases are easily compressed into smaller volumes, whereas solids and liquids are not. Because a
gaseous sample consists mostly of empty space, the gas particles are pushed closer together when
pressure is applied to a gas.
11.
Density and color are physical properties. The odor would often be described as a physical
characteristic, but since odor results from a chemical interaction between the molecules of vapor
and receptors in the nose, many scientists would classify the odor as a chemical property.
12.
chemical change; New products are formed. The reactants are water molecules, which undergoes
a chemical reaction to produce hydrogen and oxygen molecules. These are chemically different
than water molecules.
13.
Magnesium burns in air.
14.
Magnesium is malleable and ductile.
15.
The boiling of water is a physical change because the water is changing phases from a liquid to a
gas (but still remains the same substance). The flame on the stovetop and cooking the raw
noodles are chemical changes because new products are made (not the same substances you
started with).
16.
(d); The identity of the molecules that make up (a), (b) and (c) does not change, just the
rearrangement.
30

Chapter 3: Matter
17.
a.
chemical; the grease/oil inside the oven is actually converted to soap, which can then be
washed away
b.
physical; the molecules in the rubber band rearrange themselves when the rubber band is
stretched, but the identity of the molecules does not change
c.
chemical; “rust” represents the product of the reaction of iron with oxygen in the air
d.
physical; the odor is characteristic of the acid itself and does not represent any change in
the acid. However, because the perception of odor does involve a chemical process
between the molecules of vapor and receptors in the nose, some scientists would classify
odor as a chemical property.
e.
chemical; the acid breaks bonds in the cellulose molecules that constitute the cotton
fibers
f.
physical; crystallizing a pure substance from a solution does not change the identity of
the substance
g.
chemical; the green patina is a compound of copper that results from the copper metal
reacting with gases in the atmosphere
h.
chemical; the “brown” color represents the chemical breakdown of carbohydrates
(starches) in the bread
i.
physical; evaporation is a physical change
j.
chemical; the proteins, carbohydrates, and fats in the steak are converted to elemental
carbon by overheating.
k.
chemical; the “fizzing” represents the production of a new gaseous substance (oxygen
gas) from the breakdown of the hydrogen peroxide.
18.
a.
physical; the iron is only being heated.
b.
chemical; the sugars in the marshmallow are being reduced to carbon.
c.
chemical; most strips contain a peroxide which decomposes.
d.
chemical; the bleach oxidizes dyes in the fabric.
e.
physical; evaporation is only a change of state.
f
physical; the salt is only modifying the physical properties of the solution, not
undergoing a chemical reaction.
g.
chemical; the drain cleaner breaks bonds in the hair.
h.
physical; students will most likely reply that this is a physical change since the perfume is
evaporating; the sensation of smell, however, depends on chemical processes.
i.
physical; the sublimation is only a change of state.
j.
physical; the wood is only being physically divided into smaller pieces.
k.
chemical; the cellulose in the wood is reacting with oxygen gas
19.
compounds
20.
Compounds consist of two or more elements combined together chemically in a fixed
composition, no matter what their source may be. For example, water on earth consists of
molecules containing one oxygen atom and two hydrogen atoms. Water on Mars (or any other
planet) has the same composition.
31

Chapter 3: Matter
21.
compounds
22.
compounds
23.
the same
24.
HCl; Elements (e.g., He, F2, S8) cannot be broken down into other substances by chemical means.
HCl is a compound because it can be broken down into hydrogen and chlorine.
25.
This would represent a mixture: the iron and sulfur have only been placed together in the same
container at this point, but no reaction has occurred. This is confirmed by the fact that the magnet
can be used to remove the iron from the sulfur.
26.
Given that the product of the process is no longer attracted by the magnet, this strongly suggests
that the iron has been converted to an iron/sulfur compound—a pure substance.
27.
The term homogeneous in this context means that there are no variations in composition in
different areas of the mixture.
28.
c. air (in this room) and d. gasoline (for a car) are both examples of homogeneous mixtures; A
chocolate chip cookie is an example of a heterogeneous mixture. Iodine crystals are an example
of an element. Sucrose is an example of a compound.
29.
a.
mixture
b.
mixture
c.
pure substance (hopefully)
d.
mixture (the hydrogen peroxide is dissolved in water)
30.
a.
mixture
b.
mixture
c.
mixture
d.
pure substance
31.
a.
heterogeneous
b.
homogeneous (macroscopically, assuming plain mayonnaise)
c.
heterogeneous
d.
heterogeneous
e.
heterogeneous
32.
Concrete is a mixture: the various components of the particular concrete are still distinguishable
within the concrete if examined closely.
33.
Consider a salt solution (sodium chloride in water). Since water boils at a much lower
temperature than sodium chloride, the water can be boiled off from the solution, collected, and
subsequently condensed back into the liquid state. This separates the two chemical substances.
34.
Consider a mixture of salt (sodium chloride) and sand. Salt is soluble in water, sand is not. The
mixture is added to water and stirred to dissolve the salt and is then filtered. The salt solution
passes through the filter; the sand remains on the filter. The water can then be evaporated from
the salt.
35.
If water is added to the sample, and the sample is then heated to boiling, this should dissolve the
benzoic acid but not the charcoal. The hot sample could then be filtered, which would remove the
32

Chapter 3: Matter
charcoal. The solution that passed through the filter could then be cooled. This should cause some
of the benzoic acid to crystallize, or the solution could be heated carefully to boil off the water
leaving benzoic acid behind.
36.
The chemical identities of the components of the mixture are not changed by filtration or
distillation: the various components are separated by physical, not chemical, means.
37.
compound
38.
a.
compound; pure substance
b.
element; pure substance
c.
homogeneous mixture
39.
Chalk must be a compound, as it loses mass when heated, and appears to change into a substance
with different physical properties (the hard chalk turns into a crumbly substance).
40.
Because vaporized water is still the same substance as solid water, no chemical reaction has
occurred. Sublimation is a physical change.
41.
Liquids and gases both flow freely and take on the shape of their container. The molecules in
liquids are relatively close together and interact with each other, whereas the molecules in gases
are far apart from each other and do not interact with each other.
42.
False. No reaction has taken place. The substances are merely separating, not changing into
different substances. This is an example of a heterogeneous mixture.
43.
physical
44.
(b); P4 is an element. Dissolving sugar in water is not a chemical change (both the sugar and
water are still intact). NaCl is a compound.
45.
chemical
46.
physical
47.
state
48.
pure substance; compound; element
49.
a.
physical; milk contains protein, and when the vinegar is added, the acidity of the vinegar
causes a change in the protein’s shape, making it insoluble in water (see Chapter 21)
b.
chemical; exposure to the oxygen of the air allows bacteria to grow, which cause the
chemical breakdown of components of the butter.
c.
physical; salad dressing is a physical mixture of water soluble and insoluble components,
which only combine temporarily when the dressing is shaken.
d.
chemical; milk of magnesia is a base, which chemically reacts with and neutralizes the
acid of the stomach.
e.
chemical; steel consists mostly of iron, which chemically reacts with the oxygen of the
atmosphere.
f.
chemical; carbon monoxide combines chemically with the hemoglobin fraction of the
blood, making it impossible for the hemoglobin to combine with oxygen.
g.
chemical; paper consists of the carbohydrate cellulose, which is broken down chemically
by acids.
33

Chapter 3: Matter
h.
physical; sweat consists mostly of water, which consumes heat from the body in
evaporating.
i.
chemical; although the biochemical action of aspirin is not fully understood, the process
is chemical in nature.
j.
physical; oil molecules are not water soluble, and are repelled by the moisture in skin.
k.
chemical; the fact that one substance is converted into two other substances demonstrates
that this is a chemical process.
50.
The correct answer is d. sodium (element), sodium chloride (compound), salt water (mixture).
Incorrect:
a. copper (element), silicon dioxide (compound), copper(II) sulfate (compound)
b. hydrogen (element), carbon dioxide (compound), water (compound)
c. chili (mixture), pizza (mixture), steak (mixture)
e. nitrogen (element), argon (element), air (mixture)
51.
a.
heterogeneous
b.
homogeneous
c.
heterogeneous
d.
homogeneous (assuming there are no imperfections in the glass)
e.
heterogeneous
52.
a. Air is a homogeneous mixture of gases because it generally contains the same ratio of gaseous
substances from one region to another.
53.
Answer depends on student choices.
54.
False. The substances in the mixture do not always combine to form a new product. Mixtures can
be separated into pure substances, but this is not a chemical reaction.
55.
Answer depends on student choices.
56.
O2 and P4 are both still elements, even though the ordinary forms of these elements consist of
molecules containing more than one atom (but all atoms in each respective molecule are the
same). P2O5 is a compound, because it is made up of two or more different elements (not all the
atoms in the P2O5 molecule are the same).
57.
Answers depends on student response.
58.
Assuming there is enough water present in the mixture to have dissolved all the salt, filter the
mixture to separate out the sand from the mixture. Then distill the filtrate (consisting of salt and
water), which will boil off the water, leaving the salt.
34
Chapter 3: Matter
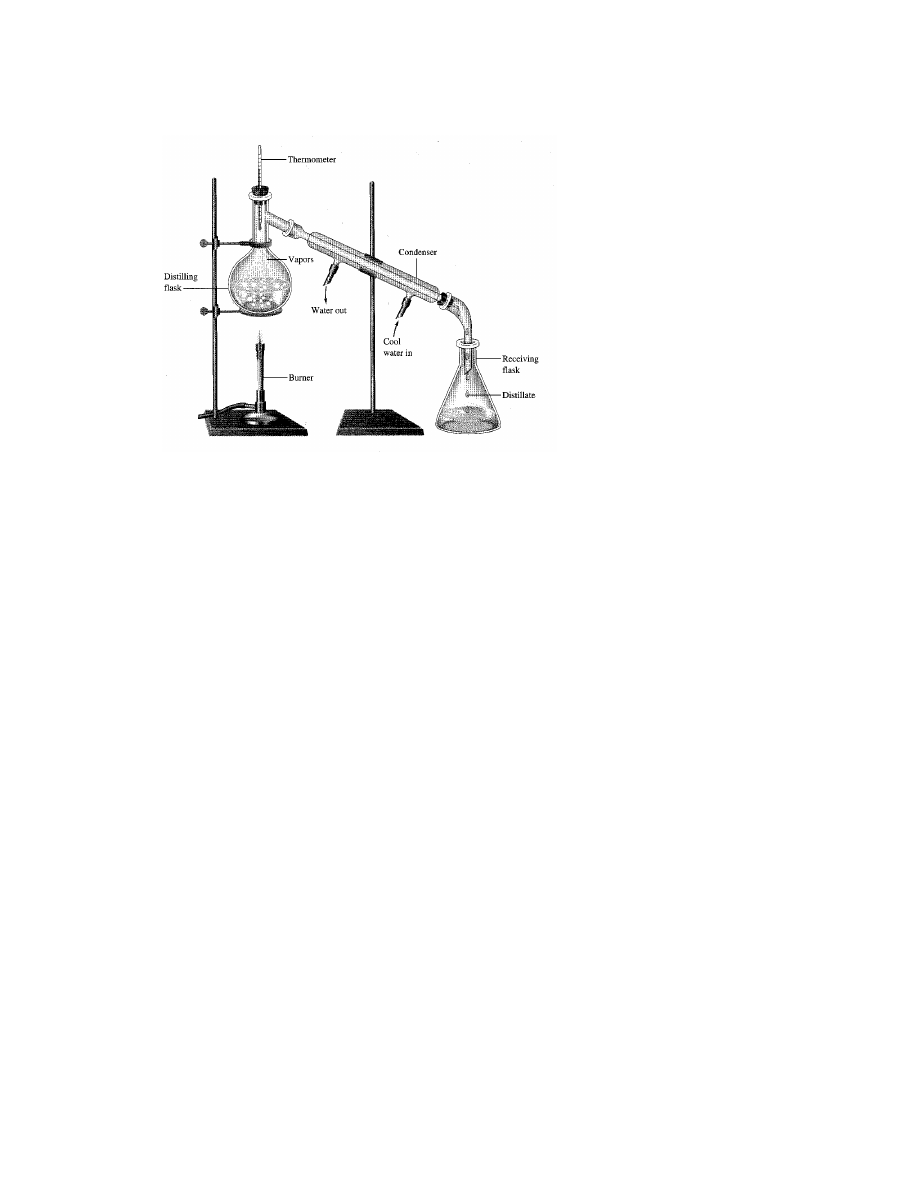
59.
See Figure 3.6 in the text.
60.
The most obvious difference is the physical states: water is a liquid under room conditions,
hydrogen and oxygen are both gases. Hydrogen is flammable. Oxygen supports combustion.
Water does neither.
61.
(b); A compound consists of two or more different elements. Mixtures consist of two or more
substances (elements and/or compounds).
62.
a.
False. A spoonful of sugar is a compound (sucrose, C12H22O11).
b.
False. Element and compounds are pure substances.
c.
True.
d.
False. Gasoline is a mixture.
e.
True.
63.
(c)
64.
(a), (d)
35